Abiraterona
A recusa dos IPO de não autorizar a prescrição de
abiraterona para tratamento de doentes com cancro da próstata suscitou reacções
justificativas do Ministério da Saúde (MS) e dos presidentes dos IPO de Lisboa
e Porto, baseadas em dois aspectos centrais -- eficácia/efectividade e
segurança, e custo -- que merecem ser examinados com algum pormenor.
Numa nota à Imprensa divulgada no passado dia 05, o MS afirma
que «a definição de um formulário e a decisão de usar determinados medicamentos
é a forma mais eficaz de garantir a qualidade dos tratamentos com medicamentos
e assegurar que os doentes não sejam expostos a riscos desnecessários e
superiores a qualquer benefício de que possam vir a usufruir. Não é apenas, nem
sobretudo, um mecanismo de contenção de custos, como se quer fazer crer»; e que
«a criação do Formulário Nacional do Medicamento, que já arrancou em algumas
áreas (sida, esclerose múltipla e cancro da próstata), baseia-se na melhor
evidência científica verificada até ao momento».
Por seu turno, o presidente do Conselho de Administração do
IPO de Lisboa, Francisco Ramos, em declarações à Lusa prestadas no mesmo dia,
afirmou que os medicamentos em causa (oncológicos) «são muito caros e com
benefícios muito reduzidos»; e o presidente do IPO do Porto, Laranja Pontes,
também a 05 de Agosto, afirmava à TVI que a abiraterona «é um medicamento novo,
mas não inovador, tem benefícios marginais», e que a sua não-inclusão no
formulário «não tem nada a ver com custos, temos medicamentos muito mais
caros».
Tendo em atenção estas posições, será útil revisitar o que a
EMA e o NICE concluíram acerca da abiraterona. E perdoar-me-ão que, antes do
mais, recorde a missão e a função de cada uma destas entidades. A missão da EMA
consiste em «promover a excelência científica na avaliação e supervisão de
medicamentos, para benefício da Saúde Pública e animal»; e a sua função, como
«agência da União Europeia responsável pela coordenação dos recursos
científicos existentes postos à sua disposição pelos Estados-membros para avaliação,
supervisão e farmacovigilância de produtos medicinais», consiste «em fornecer
aos Estados-membros e às instituições da EU o melhor aconselhamento científico
possível sobre todas as questões relacionadas com a avaliação da qualidade,
segurança e eficácia de produtos medicinais para uso humano ou veterinário»
link.
Quanto ao NICE, é sua missão «apoiar os profissionais de
saúde para lhes assegurar que os cuidados que prestam são da melhor qualidade
possível e oferecem a melhor relação benefício-custo», através de «orientações
independentes, autorizadas e baseadas na evidência sobre os meios mais
efectivos de prevenir, diagnosticar e tratar as doenças, reduzindo
desigualdades e variações» link.
EMA: Em Setembro de 2011, a EMA autorizou a entrada no mercado da
abiraterona (Zytiga®) «indicado, com prednisona ou prednisolona, para o
tratamento do cancro da próstata metástatico resistente à castração (CPMRC) em
homens adultos, cuja doença progrediu após um regime de quimioterapia baseado
em docetaxel», com base no parecer positivo do CHMP, que, «tendo em conta os
dados de qualidade, segurança e eficácia apresentados, considerou existir uma
relação benefício-risco favorável» no medicamento, «capaz de melhorar a
sobrevivência e atrasar a progressão da doença». Os seus efeitos secundários
mais comuns são «edema periférico, hipocaliemia, hipertensão e infecção do
tracto urinário».
Entretanto, a Janssen propôs a extensão da indicação
aprovada da abiraterona para incluir o «tratamento do cancro da próstata
metastático resistente à castração em homens adultos assintomáticos ou com
sintomas ligeiros, após insucesso de terapêutica de privação androgénica»
(pré-docetaxel), e, em apoio desta solicitação, apresentou novos dados de
estudos de farmacologia, farmacocinética e toxicologia, e um estudo de
avaliação de risco ambiental (seria apresentado um novo estudo, no decurso da
avaliação, a pedido do CHMP).
A EMA lembrou, a propósito, que «o prognóstico dos doentes
com CPMRC continua a ser pobre (sobrevivência média de cerca de 1-2
anos).Depois de os doentes se tornarem resistentes à castração e desde que
permaneçam assintomáticos ou tenham sintomas ligeiros, razão pela qual a
quimioterapia não está ainda indicada, podem ser utilizadas diferentes
abordagens hormonais, mas, globalmente, não existe nem um consenso claro, nem
demonstração clara de eficácia em termos de sobrevivência dos tratamentos
disponíveis. Estes doentes que não tem necessidade imediata de quimioterapia
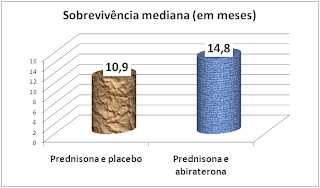
podem beneficiar de terapêuticas alternativas. Os dados do estudo COU-AA-302
demonstram vantagens significativas e clinicamente relevantes para este grupo
de doentes».
Em 15 de Setembro de 2012, o CHMP adoptou a nova indicação
da abiraterona proposta pela Janssen, e uma nova contra-indicação:
insuficiência hepática grave, classe Child-Pugh A link.
NICE: Em Fevereiro de 2012, Sir Andrew Dillon, director do NICE, o
organismo britânico reconhecido pela sua não-complacência com a Indústria
Farmacêutica (e também por ser acusado de colocar as libras à frente do
bem-estar dos doentes), dizia:
«A abiraterona é um fármaco que pode prolongar a vida por
mais de três meses, em comparação com placebo. Para os doentes, um dos
principais benefícios deste medicamento é o facto de poder ser administrado por
via oral, em casa. Lamentamos, por isso, não poder recomendar o seu uso no NHS.
É um medicamento caro, e a comissão consultiva independente que tomou esta
decisão considerou que ele não oferecia benefício suficiente aos doentes para
justificar o preço pedido ao NHS, mesmo com o desconto que o fabricante
propôs». A comissão também concluiu que o tratamento não satisfazia os
critérios do NICE para medicamentos destinados a pessoas em fim de vida, «pois
a população para a qual está aprovado não pode ser considerada pequena» link.
Todavia, em Maio do mesmo ano, o NICE reexaminou a questão e
emitiu uma nova orientação, segundo a qual «a abiraterona, em combinação com
prednisona ou prednisolona, está recomendada como uma opção para o tratamento
do CPMRC em adultos, apenas se a doença tiver progredido durante ou após um
regime de quimioterapia contendo docetaxel; e se o fabricante fornecer a
abiraterona com o desconto acordado no esquema de acesso ao fármaco pelo
doente». A comissão consultiva independente concluiu então que «a evidência
disponível demonstrou que a abiraterona era um tratamento de segunda linha
clinicamente efectivo para o CPMRC». Perdoar-me-ão mais uma vez recordar que,
de acordo com o National Center for Biotechnology Information, dos EUA, se a
eficácia é a medida em que uma intervenção faz mais bem do que mal em
circunstâncias ideais, a efectividade é a medida em que uma intervenção faz
mais bem do que mal em circunstâncias da prática clínica diária (Definições do
EU High Level Pharmaceutical Forum, Outubro de 2008, link.
A mesma comissão concluiu que «a abiraterona oferece uma
alteração qualitativa no tratamento, porque é de toma oral em casa e está
associada a poucas reacções adversas». Por outro lado, reconheceu que «a
abiraterona preencheu os critérios de tratamento de fim de vida e de
prolongamento da vida» Os peritos representantes dos doentes informaram a
comissão de que «os mais importantes benefícios da abiraterona eram o
prolongamento da vida e a melhoria da qualidade de vida, incluindo menos dor e
melhor saúde mental e física»; e de que «as reacções adversas ao tratamento com
abiraterona eram toleráveis e comparáveis às associadas ao tratamento
hormonal».
A comissão registou que «a abiraterona pode causar
hipertensão, hipocaliemia e retenção de fluidos, em consequência de um efeito
mineralocorticóide aumentado», e que «as reacções adversas eram geralmente
tratáveis e reversíveis», pelo que concluiu que «a abiraterona é geralmente
segura, e qualquer reacção adversa associada é tolerável».
O fabricante apresentou um modelo económico comparando três
tratamentos: abiraterona mais prednisolona, prednisolona em monoterapia e
mitoxantrona mais prednisolona, e um modelo de decisão baseado na
sobrevivência, com três estados de saúde -- pré-progressão, pós-progressão e
morte --, utilizando um horizonte de 10 anos de sobrevida, e a comissão
«concluiu que o modelo satisfazia de perto o caso de referência do NICE para a
análise económica».
Tudo isto considerado, a comissão «reconheceu que a
abiraterona oferece benefícios na qualidade de vida relacionada com a saúde,
para além dos demonstrados no cálculo dos QALY a doentes que recebem
mitoxantrona, e que o ratio de custo-efectividade incremental (RCEI)
diminuiria, se estes benefícios fossem tomados em conta. O benefício
relacionado com a via de administração oral da abiraterona não foi detectado na
análise, porque o modelo aplicou o mesmo benefício de utilidade à abiraterona e
à mitoxantrona». Tendo em conta estes factores, a comissão nota que, embora o
RCEI (ou seja, o ratio entre a diferença nos custos dividida pela diferença nos
efeitos) mais plausível «será provavelmente superior ao cálculo do fabricante,
46 800 libras por QALY ganho, para o subgrupo de doentes com quimioterapia
prévia, será provavelmente inferior a 50 000 libras» link.
Guidelines da NCCN
As guidelines da National Comprehensive Cancer Network
(NCCN), uma rede de 23 dos mais importantes centros oncológicos do Mundo,
incluem, entre as opções terapêuticas adicionais após insucesso do docetaxel, a
abiraterona, com categoria de evidência 1. O fármaco, associado a prednisona,
«demonstrou benefício clínico e representa um novo padrão de cuidados para
doentes com CPMRC» link.
Concordar-se-á que não é fácil compaginar as conclusões da
EMA, do insuspeito NICE e da NCCN com as posições assumidas para justificar a
não-adopção plena da abiraterona pelo SNS -- o que impede considerá-la no
formulário --, nas indicações com que foi aprovada pela EMA. De facto, a defesa
pelo MS da «qualidade dos tratamentos com medicamentos» e a necessidade de
«assegurar que os doentes não sejam expostos a riscos desnecessários e
superiores a qualquer benefício de que possam vir a usufruir» são inatacáveis,
mas não parece, à luz do que acima ficou dito, que o tratamento com abiraterona
exponha os doentes a riscos desnecessários e superiores a qualquer benefício de
que possam vir a usufruir; pelo contrário, se procurarmos «a melhor evidência
científica verificada até ao momento», que o MS reivindica como base para a
criação do Formulário Nacional do Medicamento, encontramos que, para o CHMP,
«os dados do estudo COU-AA-302 demonstram vantagens significativas e
clinicamente relevantes» da abiraterona, razão pela qual, «tendo em conta os
dados de qualidade, segurança e eficácia apresentados», considerou «existir uma
relação benefício-risco favorável» no medicamento, «capaz de melhorar a
sobrevivência e atrasar a progressão da doença».
Por sua vez, o NICE concluiu que «a abiraterona oferece uma
alteração qualitativa no tratamento», e as guidelines da NCCN reconhecem que
ela «representa um novo padrão de cuidados para doentes com CPMRC», o que
dificilmente se coaduna com a afirmação do presidente do IPO do Porto, Laranja
Pontes, de que «é um medicamento novo, mas não inovador», e de que a sua
não-inclusão no formulário «não tem nada a ver com custos»; e contraria a
alegação de que os benefícios são «reduzidos» (Francisco Ramos, presidente do
IPO de Lisboa) ou «marginais» (Laranja Pontes).
No que respeita a segurança, são tranquilizadoras as
conclusões do CHMP da EMA, já referidas, e do NICE: «A abiraterona é geralmente
segura, e qualquer reacção adversa associada é tolerável».
Contenção de custos
Assim, no caso vertente, a contenção de custos é o que
sobrevive da argumentação empregue para manter a abiraterona (e outros
medicamentos) no limbo -- a edição do Expresso do passado dia 05 noticia,
invocando fonte do MS, que, «por contenção de encargos com medicamentos»,
continuam sem chegar aos hospitais públicos 31 novos fármacos (para tratar
asma, hipertensão, epilepsia ou diabetes), já com visto técnico e económico
para serem utilizados de forma generalizada link.
O presidente do IPO do Porto desmentiu-se, aliás, a si próprio, ao afirmar que
a não-inclusão da abiraterona no formulário «não tem nada a ver com custos»,
por um lado, e, por outro, ao revelar que a Janssen «não quis apresentar o
estudo fármaco-económico que é necessário para a sua (abiraterona) introdução
no SNS» (Público, 5/8). No Reino Unido, a Janssen propôs ao NICE um desconto no
preço; não sabemos se terá tomado idêntica iniciativa em Portugal.
Ninguém ignora que o País está sob um programa de resgate
financeiro, que as metas da troika são exigentes, que os cortes impostos na
despesa são brutais. Em suma, que o Ministério da Saúde, como os outros, se
debate com difíceis opções. Será impossível explicá-las apenas pelos seus verdadeiros
fundamentos? Não; foi o que fez a abençoada fonte contactada pelo Expresso; não
se pronunciou sobre eficácia e efectividade, ou magnitude de benefícios para os
doentes. Disse, simplesmente, que não há dinheiro.
Ah, mas no Ministério da Educação, há. O ministro Crato
propõe-se apoiar financeiramente a frequência de escolas do ensino particular e
cooperativo por parte de todos os alunos do ensino básico e do ensino
secundário, cujos pais o desejem, isto é, dispõe-se a pagar duas vezes os dois
tipos de ensino: público e privado. Peça-lhe algum, Dr. Paulo Macedo, que
redundâncias destas só para ricos...
Em tempo: Leio no
Expresso do passado dia 17 que «o Estado dá aos funcionários públicos doentes
com cancro medicamentos que recusa aos restantes portugueses. Nos hospitais
públicos, os médicos só podem prescrever terapêuticas aprovadas após um
demorado processo, enquanto nos hospitais privados paga, na íntegra, aos
beneficiários da ADSE os remédios logo que entram no mercado nacional.
«O Ministério das Finanças, responsável por este sistema de
protecção social dos funcionários públicos do sector administrativo até 2014,
confirma a discrepância de critérios. E revela até que as comparticipações a
100% para os antineoplásicos, incluindo os inovadores, são extensíveis a outros
medicamentos (...) Por exemplo, a abiraterona, para o cancro da próstata
metastizado, recusada a doentes em vários hospitais públicos, incluindo nos
três centros do Instituto Português de Oncologia, e que ainda está em avaliação
pelo Infarmed para comparticipação, é dada aos beneficiários da ADSE nos
hospitais privados desde que começou a ser comercializada em Portugal, em
Outubro de 2011» link.
Não, não vou citar o consabido aforismo do Animal Farm, de
Orwell; limito-me a notar que, afinal, contrariamente ao que nos pretendem
fazer crer, os estudos de fármaco-economia nem sempre são indispensáveis. E
lembro uma história contada pelo Dr. Amaral Canelas no 9.º Congressso Nacional
das Unidades de Oncologia, em Maio último.
Foi quando o trastuzumab passou a ser utilizado no cancro da
mama. Por alturas de uma reunião médica em Copenhaga, o medicamento já tinha
sido autorizado no Serviço Nacional de Saúde da Holanda, mas na Dinamarca ainda
não, e, por isso, doentes dinamarquesas iam à Holanda fazer o tratamento. «Mas
aqui, na Dinamarca, se a doente pode pagar o tratamento numa instituição
privada, por que o não faz?», perguntou o português. «Porque aqui ou é para
todos ou não é para ninguém».
Algo val mal no reino de Portugal...
João Paulo de Oliveira, Editor do «Tempo Medicina»
Etiquetas: Medicamento





















0 Comments:
Enviar um comentário
<< Home